Реакциона једињења: примјери и формула
У току школског програма разматра се реакција размене, супституције, једињења, разлагања. Хајде да анализирамо особине сваког типа, дајемо примјере интеракција.
Дефиниција појма
Каква је реакција једињења,примери који се разматрају у општим образовним институцијама у првој фази обуке? За почетак, примећујемо да се појам "хемијска реакција" у хемији сматра другим најважнијим.
У нашем свету, реакција једињења се одвија сваког минута, а једначине које су нам познате, али их и не размишљамо.
На пример, производња газираних пића, сагоревање дрвета за дрва су типични примјери сложених реакција.
Овај процес укључује добијање производа са одређеним квалитативним и квантитативним саставом од првобитних хемикалија.

Знаци хемијских реакција
Сваки процес, укључујући хемијску реакцију једињења, прати одређени знаци:
- ослобађање светлости или топлоте;
- промена боје рјешења;
- ослобађање гасовите супстанце;
- појаву специфичног мириса;
- растварање или падавина.
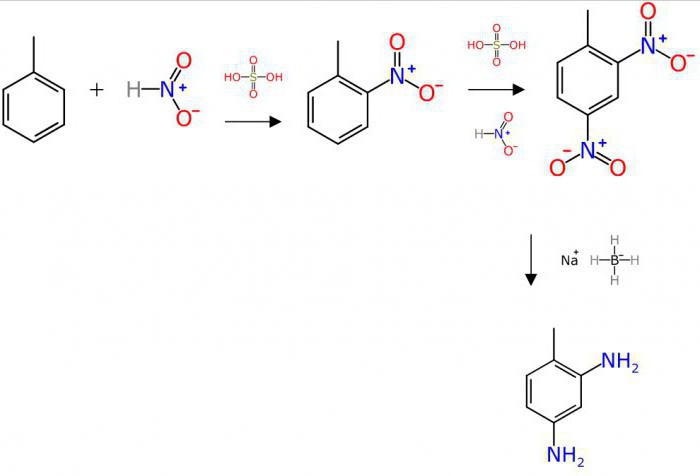
Услови реакције
У зависности од карактеристика квалитативног и квантитативног састава, хемијска реакција једињења може да се настави под различитим условима.
На пример, интеракција облика 2Ца + О2 = 2ЦаО (гашење креча) токови без предгревања, праћени ослобађањем значајне количине топлотне енергије.
Како се реакција једињења формира правилно? Једначине таквих процеса претпостављају писање почетних супстанци на левој страни, а производ реакције формира се са десне стране.
4На + О2 = 2На2О
Такви процеси су инхерентни органским супстанцама. Дакле, квалитативна реакција на неизвесност (присуство вишеструке везе) је реакција оксидације почетног материјала са калијум перманганатом.

Спаљивање дрва за огрев
Овај процес се наставља према једначини:
Ц + О2 = ЦО2
Ово је типична реакција једињења, примера тогавећ су цитирани горе. Која је суштина овог процеса? Кад се дрво дренаже са кисеоником у ваздуху, формирају се угљен-диоксидни молекули. Процес је праћен формирањем новог молекула спојене везе, је егзотермна реакција.
Да ли је могуће између реакције комплексних супстанцивезе? Примери интеракција са једноставним супстанцама су већ описани, али овај тип је такође карактеристичан за сложене супстанце. Типична варијанта такве интеракције је реакција кречења креча.
ЦаО + Х2О = Ца (ОХ)2
Овај процес је праћен и са ослобађањем значајне количине топлотне енергије. Међу специфичним карактеристикама овог процеса примећује се његова спонтаност.
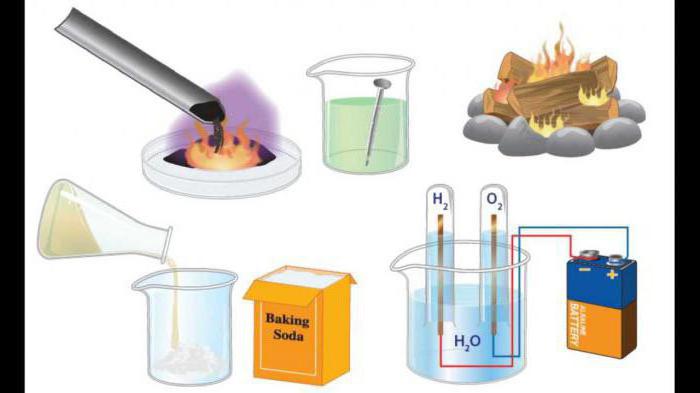
Класификација
Састав почетних супстанци и реакционих производа ослобађа реакцију једињења, разлагања, супституције, размене. Размотримо њихове примјере, али и дати дефиниције таквих процеса.
Замена је замена дела једињења атомима једноставне супстанце.
Придруживање је процес комбиновања неколико једноставних или комплексних супстанци у један сложенији. Примери таквих процеса могу се извести из неорганске и органске хемије.
2Х2 + О2 = 2Х2 О
Овај процес се одвија са ослобађањем значајне количине топлоте, тако да је могућа експлозија.
Ц2 Х4 + Х2 = Ц2 Х6
Када се водоник пролази кроз етилен, двострука веза се разбија, формира се засићени угљоводоник.
Разлагање - ово су хемијске реакције које резултирају стварањем неколико супстанци из једног комплексног једињења, имајући једноставнији квалитативни и квантитативни састав.
Реакције јонске разменеа су процеси који се јављају између сложених супстанци, због чега се одвија размјена компоненти.
Постоје три услова за проток таквог процеса: еволуција гаса, преципитација седимента, формирање слабо дисоциране супстанце.
Та интеракција се назива естерификација, тако дајер је крајњи производ реакције естер. Стање процеса у правцу смера је увођење концентроване сумпорне киселине у реакциону смешу.

Подела према агрегатном стању интеракција супстанци
Сви хемијски процеси су класификовани према томезнак хомогених и хетерогених интеракција. У првом случају, почетне материје и производи реакције су у истом агрегатном стању, а за хетерогене врсте је дозвољено друго стање.
На пример, следећа интеракција биће хомогени процес:
Х2(гас) + Цл2(гас) = 2ХЦл (гас)
Следећа варијанта може се сматрати хетерогеном реакцијом:
ЦаО (с) + Х2О (г) = Ца (ОХ)2 (п-п)

Промјеном степена оксидације
Реакција једињења, чија је формула билаје дат горе (формирање воде из једноставних супстанци), процес оксидације и редукције. Суштина процеса лежи у чињеници да се прихватање и ослобађање електрона одвија.
Међу реакцијама једињења постоје и такви процеси који нису праћени промјеном ступњева оксидације, односно нису ОВР:
ЦаО + Х2О = Ца (ОХ)2
По природи цурења
У зависности од тога да ли се процес може одвијати само у правцу напријед или ако се реакција одвија у супротном правцу, у хемији се разликују неповратна и реверзибилна интеракција.
На пример, квалитативни одговор на органскеједињење је неповратно, јер води до стварања нерастворне или гасовите супстанце. Пример такве квалитативне интеракције је реакција "сребрног огледала", што је квалитативна метода одређивања у мешавини алдехида.
Међу типичним варијантама реверзибилних реакција које су способне да тече у два узајамно супротна правца, запажамо реакцију естерификације:
ЦО2 + Х2О = Х2ЦО3
О употреби катализатора
У неким случајевима, неопходно је користити акцелератор (катализатор) како би се хемијски процес наставио. Пример каталитичке интеракције је разградња водоник-пероксида.

Карактеристике ИРС разарања
Међу проблемима који најчешће узрокујутешкоће за ученике, је распоред коефицијента у реакцији коришћењем методе електронске равнотеже. За почетак, постоје одређена правила према којима је у свакој супстанци могуће одредити оксидационо стање појединих елемената.
Без обзира да ли се узима у обзир једноставна или сложена супстанца, њихова сума мора бити нула.
Следећа фаза ће бити избор тих супстанци илиодвојени хемијски елементи, у којима се променила вредност степена оксидације. Они пишу одвојено, показујући знакове "плус" или "минус" број примљених или датих електрона.
Између ових цифара налази се најмањи број, када се дели са бројем примљених и датих електрона, добиће се цели бројеви.
Добијени бројеви су стереохемијскикоефицијенти, распоређени у једначину предложеног процеса. Важна фаза у анализи реакција редукције оксидације је одређивање оксидационог агенса и редукционог средства, као и евидентирање процеса који се јављају. Као средство за редукцију, изабрани су ти атоми или јони који су током интеракције повећали своје оксидационо стање, за оксидацију, напротив, карактеристичан је пад овог индекса.
Да ли овај алгоритам претпоставља било којиорганска хемија? Реакција једињења, супституције, распадања, протока са променом стања оксидације разматра сличан алгоритам.
Постоје одређене особине у распореду степена оксидације у органским једињењима, али њихова сума такође треба бити нула.
У зависности од тога како се степен оксидације мења, разликују се неколико врста хемијских интеракција:
- диспропорционација - повезан је са промјеном степена оксидације једног и истог елемента у већој или мањој мери;
- цоунтерпропортионатион - укључује интеракцију редукујућег средства и оксидатора, који садрже исти елемент, али у различитим степенима оксидације.
Закључак
Као мали резиме, примећујемо да кадаИнтеракција супстанци међусобно су њихове промене, трансформације. Хемијске реакције су претварање једног или више реагенса у производе који имају различити квалитативни и квантитативни састав.
Ако се промени у нуклеарним трансформацијамасастав атомских језгара, онда у случају хемијских реакција то није случај, јавља се само редистрибуција језгра и електрона, што доводи до појаве нових једињења.
Постојећи процеси могу бити праћени ослобађањем светлости, топлоте, појавом мириса, падавинама, стварањем гасних супстанци.
Постоји много варијанти класификацијеорганске и неорганске интеракције на различитим основама. Међу најчешћим варијантама можемо поменути промену стања оксидације, агрегатно стање, реверзибилност протока, механизам процеса, употребу катализатора (инхибитор).
Хемијске реакције су основа не само индустријске производње, већ и основе живота. Без метаболичких процеса који се одвијају у живим организмима, постојање би било немогуће.
</ п>


