Шта је мољ у хемији? Дефиниција и формуле
Са концептом "мољца" се суочава сваки школски ученик,који почиње проучавати хемију. Са сложенијим концептима, као што су моларна маса, моларна концентрација, моларност растварача, тешко је разумјети без знања о томе шта је мол. Може се закључити да је крт један од најважнијих појмова у хемији. Многи задаци се не могу решити без навођења броја кртица.
Дефиниција
Дакле, шта је мољац у хемији? Објашњење је прилично једноставно: то је јединица у којој се изражава количина супстанце, једна од СИ јединица. Дефиниција онога што је мол у хемији може се формулисати на овај начин: 1 мол је еквивалентан истој количини супстанце као и структурне честице садржане у 12 г угљеника-12.
Утврђено је да 12 г овог изотопа садржи број атома нумерички једнак Авогадро константи.
Порекло концепта
Мало схватања о чему се радихемију помоћу дефиниција, обратимо се историји овог концепта. Као што се уобичајено верује, појам "мол" уведен је од стране немачког хемичара Вилхелма Освалда, који је 1909. године добио Нобелову награду. Реч "мол" очигледно долази од речи "молекула".

Интересантна чињеница је Авогадрова хипотеза о томепод истим условима, исте количине супстанце садржане су у истим количинама различитих гасова, постављено је много пре Освалда, а саму константу израчунава Авогадро почетком деветнаестог века. То јест, иако концепт "кртица" није постојао, сама идеја о количини супстанце је већ била тамо.
Основне формуле

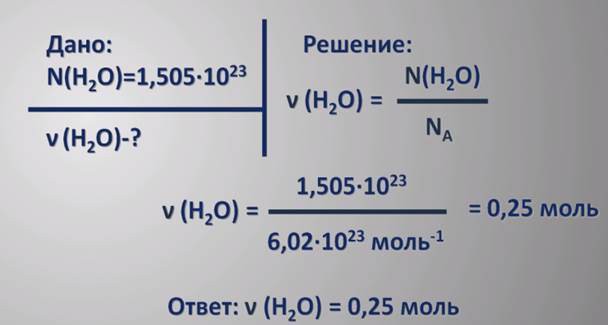
Количина супстанце је различита, у зависности од података о задацима. Овај облик има најчешћу формулу у којој се ова количина изражава односом масе и моларне масе:
н = м / М
Вреди вриједити да је количина материје количинаадитив. То јест, да бисте израчунали вриједност ове вриједности за смешу, прво морате одредити количину материје за сваки од његових елемената и додати их.
Још једна формула се примјењује ако је познат број честица:
н = Н / На
Ако задатак указује на то да се процес јавља каданормални услови, можемо користити следеће правило: у нормалним условима, сваки гас заузима инвариантну запремину од 22,4 литара. Тада можемо користити следећи израз:
н-В / Вм
Количина материје изражена је Цлапеироновом једначином:
н = пВ / (РТ)
Знајући шта је мол у хемији и основнимформуле за одређивање броја молова супстанце, омогућавају много брже рјешавање многих проблема. Ако знате количину материје, можете наћи масу, запремину, густину и друге параметре.
</ п>